|
|
LE CONTROLE DE LA DOULEUR
|
| Nous possédons des récepteurs sensoriels à haut seuil mis en jeu uniquement par des stimulations provoquant des lésions de l'organisme. Ces stimulations nocives mettent en jeu des "nocicepteurs", dont l'activité
provoque une sensation consciente particulière :
la douleur, le message nociceptif suivant les principales voies neuronales impliquées dans la nociception (voie spinothalamique et voie spino-réticulo-thalamique). Il faut, en effet, avant tout ne pas confondre douleur et nociception. La nociception est le processus sensoriel à l'origine
du message nerveux qui provoque la douleur. La douleur nous
apprend à éviter les situations dangereuse. C'est
avant tout un signal d'alarme qui met en jeu des réflexes de protection nous permettant de nous soustraire aux stimulus nocifs - de soulager les parties de notre corps soumises à de trop fortes tensions. Les rares patients naissant avec un déficit de la sensation douloureuse vivent avec le risque permanent de s'autodétruire puisqu'ils ne réalisent jamais quand ils se font mal - ils meurent en général assez jeunes. La douleur peut être modifiée
à la fois par des informations sensorielles non douloureuses
et par l'activité de structures supra-spinales. Les nocicepteurs peuvent être très activés sans qu'il y ait douleur - à l'opposé, une douleur peut être très intense sans activation majeure des nocicepteurs. Nous savons tous qu'une forte émotion, un état de stress aigu ou même simplement une intense concentration peuvent supprimer une sensation douloureuse : qui ne s'est pas coupé sans s'en rendre compte, obnubilé par l'exécution d'une tâche prennante ? |
LA MOELLE ÉPINIÈRE, PREMIER NIVEAU D'INTÉGRATION
|
| Il existe, dans les couches I et II,
des neurones purement nociceptifs, sélectivement
activés par des stimulus nocicepteurs mécaniques
ou polymodaux (mécaniques et thermiques). D'autres neurones
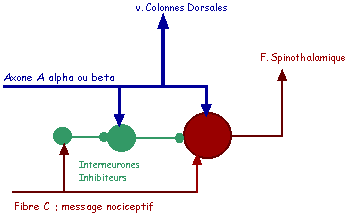
sont mixtes ou convergents : ils sont activés, à la fois, par des stimulus mécaniques cutanés légers non nociceptifs et par des stimulus nociceptifs. La réponse d'un neurone spinal, excité par des influx douloureux (fibres A delta et C), peut être inhibée (inhibition présynaptique) par un message simultané non nociceptif dans les fibres de gros et moyen calibres (A alpha et A beta) : la stimulation nociceptive (barre rouge) active un neurone convergent de la couche II (PA) - cette activation est inhibée par la stimulation des grosses fibres passant par les colonnes dorsales (proprioception / tact léger - barre noire). Ainsi, instinctivement, nous nous frottons le bras quand il est meurtri et ce, pour atténuer la douleur. |
Il
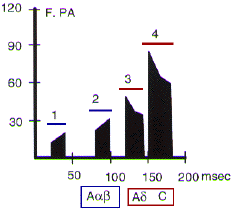
existe dans la couche V, des neurones déjà excités par des stimulus mécaniques légers (mouvements des poils [1], pression [2]), mais dont la marge de réponse est telle que leur décharge croît au fur et à mesure que le stimulus devient plus intense, jusqu'à être franchement nociceptif (pincement [4]). Les réponses précoces de ces neurones sont dues à la stimulation des fibres A alpha et A beta et les réponses tardives aux stimulations des fibres A delta et C. Ces
cellules dites "à large gamme de réponse"
("wide dynamic range") sont largement convergentes : elles reçoivent à la fois des stimulus somatiques (nociceptifs ou non) et viscéraux. Les neurones "à large gamme de réponse" témoignent également de facilitations prolongées sous l'effet d'excitations par les fibres C ("hyperalgie"). Enfin, sous l'effet de stimulus thermiques élevés, ils développent des décharges de longue durée (douleur lente). |
 |
 |
| Les
phénomènes de convergence entre influx somatiques
nociceptifs et non nociceptifs sont à l'origine d'une
hypothèse, proposée par Ronald Melzack et Patrick
Wall, sur l'existence d'un contrôle segmentaire spinal
des influx douloureux par des influx non nociceptifs. L'intégration
et la modulation du message douloureux se ferait avant l'arrivée
du signal sur la première synapse (neurone de la couche
V): lorsque l'activité des fibres A alpha et A beta prédomine,
les messages nociceptifs passent mal; lorsque les messages nociceptifs
prédominent, la "porte" s'ouvre davantage et
il peut se produire une véritable invasion centrale par
les messages douloureux (théorie de "la porte"
ou "gate control"). La douleur résulte
alors d'un déséquilibre fonctionnel dans la densité
relative des messages le long des divers types de fibres. |
Les
phénomènes de convergence somatique et viscérale
expliquent les phénomènes des douleurs rapportées (douleurs axillaires et brachiales gauches de l'angor; douleurs "en bretelle" des coliques hépatiques). La douleur est "rapportée" à la région cutanée périphérique innervée par le même segment médullaire que l'organe lésé, les afférences cutanées et les afférences viscérales se projetant sur les mêmes neurones médullaires. |
 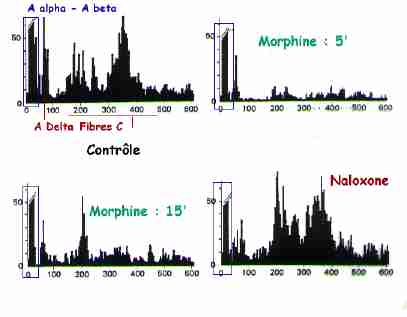
Noter l'inhibition - par la morphine - de la réponse du neurone de la couche V à la stimulation des fibres A delta et C. La morphine est sans effet sur la réponse du neurone à la stimulation des fibres A alpha et A beta. La morphine est sans effet après injection de naloxone, bloqueur spécifique des récepteurs opiacés.
|
| C'est aussi au niveau spinal que l'on a
pu montrer le rôle de la morphine sur les influx douloureux. Injectée par voie systèmique, la morphine déprime l'activité spontanée des neurones de la couche I mais surtout des neurones convergents de la couche V. Elle réduit considérablement leurs réponses à des stimulus douloureux dus à la stimulation de fibres A delta et C et n'agit pas sur les réponses liées à la stimulation des fibres A alpha et A beta (stimulation tactile légère). Ces effets sont dose-dépendants et bloqués par la naloxone, antagoniste spécifique de la morphine. Le site d'action de la morphine se situe dans les couches superficielles de la corne dorsale (couche II : substance gélatineuse de Rolando). On sait par ailleurs que les fibres A delta et C libèrent du glutamate et de la substance P (neuromodulation). In vitro, la libération de substance P est inhibée par la morphine et la met-enképhaline (effet bloqué par la naloxone). On présume donc de l'existence d'interneurones médullaires enképhalinergiques (neuropeptides opioïdes), qui moduleraient, par des mécanismes pré et/ou postsynaptiques, le transfert de l'information nociceptive. |
LES STRUCTURES SUPRA SPINALES
|
| Certaines structures supra-spinales ont des effets inhibiteurs sur les influx nociceptifs. Ces contrôles inhibiteurs peuvent être non spécifiques ou spécifiques. La stimulation de la formation réticulée
mésencéphalique, qui joue un grand rôle dans le contrôle de la vigilance, entraîne une facilitation des réflexes monosynaptiques et une inhibition des réflexes nociceptifs. Si notre attention est focalisée sur une tâche captivante, nous pouvons "oublier" une douleur intercurrente. La stimulation répétitive de la région médiane du tronc cérébral (substance
grise périaqueducale, noyaux du raphé) entraîne une analgésie de plusieurs heures par une action inhibitrice puissante et spécifique des neurones de la couche I et surtout de la couche V de la moelle. Les fibres descendantes projettent sur la couche II - centre de relais au niveau duquel les influx périphériques sont modulés par les influx inhibiteurs ou facilitateurs (mal connus) des centres supra-spinaux. |
|
