LES MÉCANISMES IONIQUES À L'ORIGINE DU POTENTIEL DE REPOS
Dans toutes les cellules, la répartition des ions de part et d'autre de la membrane est inégale. Les principaux ions libres rencontrés sont les ions Na+, K+, Ca2+ et Cl-.
|
|
LA DISTRIBUTION DES IONS DE PART ET D'AUTRE D'UNE MEMBRANE PLASMIQUE OBÉIT À DEUX GRANDS PRINCIPES : L'ÉLECTRONEUTRALITÉ ET L'ÉQUILIBRE OSMOTIQUE
|
|
Les solutions ioniques des milieux intra et extracellulaire doivent être électriquement neutre. Elles doivent chacune contenir autant d'anions (A-) que de cations (C+). C'est le principe de l'électroneutralité.
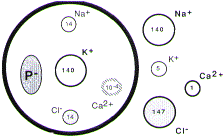
|
Milieu Extérieur
|
[CATIONS]e = [ANIONS]e en mEq
|
[Na]e + [K]e + 2 x [Ca]e = [Cl]e
140 + 5 + (2 x 1) = 147
|
|
Milieu Intérieur
|
[CATIONS]i = [ANIONS]i en mEq
|
[Na]i + [K]i + 2 x [Ca]i = [Cl]i + [P]i
14 + 140 + (2 x 10-4) = 14 + [P]i
[P]i = - 140 mEq
|
|
|
Le nombre de particules en solution situé de chaque côté de la membrane doit être le même, quelle que soit la charge de ces particules. C'est l'équilibre osmotique. En effet, si la pression osmotique des deux milieux n'est pas égale, il se produira des mouvements d'eau (du milieu le moins concentré vers le milieu le plus concentré) qui modifieront le volume cellulaire.
[IONS]e = [IONS]i en mOsm
|
[Na]e + [K]e + [Ca]e + [Cl]e = [Na]i + [K]i + [Ca]i + [Cl]i + [P]i
140 + 5 + 1 + 147 = 14 + 140 + 10-4 + 14 + [P]i
[P]i = 125 mOsm
Valence de P = - 140 / 125 = - 1,12
|
|
|
L'EXISTENCE D'UN GRADIENT DE CONCENTRATION D'UN ION DE PART ET D'AUTRE D'UNE MEMBRANE PERMÉABLE À CET ION ENTRAÎNE LA FORMATION D'UN GRADIENT ÉLECTRIQUE
|
|
Soit une membrane séparant deux compartiments 1 et 2, contenant des solutions ioniques isotoniques. Cette membrane est perméable à l'eau et aux cations (+) mais imperméable aux anions (-). La concentration en anions (-) et en cations (+) est plus élevée dans le compartiment 1 que dans le compartiment 2.
|
A. Sous l'influence du gradient de concentration : [C+]1 > [C+]2, les cations, seuls diffusibles, vont passer du compartiment 1 vers le compartiment 2 (flèches noires). Ces cations, quittant le compartiment 1, libèrent les charges (-) des anions non diffusibles et créent un excédent de charges (+) dans le compartiment 2. Le travail fourni pour déplacer un ion le long de son gradient de concentration dépend :
de la constante des gaz parfaits R = 8.314 joules / mol./ °K
de la température absolue T° Kelvin = T° Celsius + 273
des concentrations dans chaque compartiment [C+]1 & [C+]2
tel que : W [ ] = R. T. ln [C+]2 / [C+]1
B. Le transfert des cations de 1 vers 2 a "polarisé" la membrane [1 : (-) - 2 : (+)] et crée un gradient électrostatique de 2 vers 1, qui tend à s'opposer à la fuite ionique né du gradient de concentration. Le travail électrostatique, s'opposant à la diffusion de l'ion dépend :
de la valence de l'ion Z
de la quantité d'électricité que représente un ion gramme F = Faraday = 96 500 coulombs
de la force électromotrice générée E
|
Le flux ionique né d'un gradient de concentration est autolimité par le champ électrique qu'il engendre.
Z. F. E. = R. T. ln [C+]2 / [C+]1
Eion (Volts) = R .T / Z . F . ln [C+]2 / [C+]1
ÉQUATION DE NERNST
|
| ATTENTION !
Pour effectuer ces calculs, nous partons, à chaque fois, du principe que la membrane est perméable à un seul ion et imperméable aux autres. De plus, les valeurs calculées varient selon les cellules en fonction des concentrations ioniques des milieux extra- et intracellulaires comme de la température centrale de l'espèce (invertébrés ou mammifères ) à laquelle appartiennent les cellules étudiées.
Soit une membrane neuronale de mammifère :
T = 37°C = 37 + 273 = 310 °K
R . T / F = (8.314 . 310) / 96 500 = 0.026
ln = 2.3 log10
1 Volt = 1 000 millivolts (mV)
Si, par convention, le milieu extracellulaire est le milieu de référence et que nous prenions les valeurs des concentrations ioniques extra- ([ion]e) et intracellulaires ([ion]i) indiquées sur la figure :
Eion (mV) = [(1 000 x 0.026 x 2.3) / Z] log10 [ion]e / [ion]i = 60 / Z log10 [ion]e / [ion]i
| Potentiel d'équilibre des ions K+ |
EK = - 87 mV
|
| Potentiel d'équilibre des ions Na+ |
ENa = + 60 mV
|
| Potentiel d'équilibre des ions Ca2+ |
ECa = + 120 mV
|
| Potentiel d'équilibre des ions Cl- |
ECl = - 61 mV
|
 [SUITE] [SUITE]
|
