|
|
PERMÉABILITÉ MEMBRANAIRE ET CANAUX IONIQUES : LES MÉCANISMES MEMBRANAIRES À L'ORIGINE DU POTENTIEL DE REPOS
|
| Nous savons
que, la couche bilipidique étant imperméable aux
ions, les mouvements passifs des ions ne se font qu'au niveau
de protéines transmembranaires spécialisées
: les protéines-canaux dont la structure tridimensionnelle
délimite un pore aqueux au travers duquel passent sélectivement
certains ions. Elles assurent elles-mêmes le passage des
ions à travers la membrane - elles sont aussi appelées
canaux ioniques. |
1. LE GRADIENT ÉLECTROCHIMIQUE : Vm - Eion
Pour traverser la membrane, un ion est soumis à un gradient électrochimique (ou "driving-force" des anglo-saxons), qui s'exprime par la différence entre le potentiel de membrane (Vm) de la cellule et le potentiel d'équilibre de l'ion considéré (Eion). Le flux net d'une espèce ionique au travers de ses propres canaux est proportionnel à ce gradient électrochimique.
|
POTENTIEL D'EQUILIBRE
|
GRADIENT ELECTRO-CHIMIQUE
|
FLUX NET
|
| EK = - 87 mV |
Vm - EK = -60 - (-87) = + 27 mV |
SORTANT
|
| ENa = + 60 mV |
Vm - ENa = -60 - (+60) = - 120 mV |
ENTRANT
|
| ECa = + 120 mV |
Vm - ECa = -60 - (+120) = - 180 mV |
ENTRANT
|
| ECl = - 61 mV |
Vm - ECl = -60 - (-61) = + 1 mV |
ÉQUILIBRE
|
| Par convention, le flux net est positif quand un cation a tendance à sortir de la cellule et est négatif quand le cation a tendance à y entrer. |
|
2. LA CONDUCTANCE IONIQUE MEMBRANAIRE
D'une manière générale, la conductance électrique (exprimée en Siemens, S) mesure la facilité avec laquelle un courant se déplace entre deux points : c'est l'inverse de la résistance (exprimée en ohms, W).
Dans le cas d'un canal ionique, la conductance caractérise la facilité avec laquelle les ions traversent le pore aqueux de la protéine-canal.
|
|
La conductance de toute la membrane d'une cellule pour un ion (conductance ionique membranaire), gion, est proportionnelle à la conductance élémentaire d'un canal ionique : gion, mais aussi au nombre total de canaux de l'espèce ionique considérée dans la membrane : Nion et à la probabilité p0 pour que ces canaux soient à l'état ouvert :
|
|
La valeur de gion peut varier de 10 à 200 pS (1 picoSiemens, pS = 10-12 Siemens) selon le type de canal ionique. Notons que la plupart des canaux ioniques ne sont pas parfaitement sélectifs : la mesure de gion dépend donc des conditions expérimentales et, en particulier, de la présence d'autres ions.
|
3. LES COURANTS IONIQUES
L'électrophysiologiste mesure des courants. L'intensité du courant (Iion, exprimé en Ampères : Coulombs.sec-1) traversant un canal ionique ou courant ionique élémentaire est égale à :
|
Courant ionique membranaire (Iion) = gion (Vm - Eion)
ce qui n'est que la transposition de la loi d'Ohm (V = RI donc I = g V) à un gradient électrochimique
|
4. LA MEMBRANE NEURONALE EST PERMÉABLE À PLUSIEURS IONS : DÉTERMINATION DU POTENTIEL DE REPOS
On pensait, au début (J. Bernstein, 1902), que la membrane neuronale était sélectivement perméable aux ions K+. Des études plus récentes ont pu montrer que la membrane neuronale au repos est perméable, à la fois, aux ions K+ et Na+. Il apparaît simplement, qu'au repos, la conductance membranaire des ions K+ (gK) est plus grande que celle des ions Na+ (gNa).
|
|
Supposons une cellule dont la membrane comporte, à la fois, des canaux K+ et Na+ ouverts. Nous savons que cette cellule dispose de mécanismes de transport actif (pompe Na+/K+/ATPase) qui permettent de maintenir les concentrations des ions K+ et Na+, de part et d'autre de la membrane, constantes. Les potentiels d'équilibre des ions K+ (EK) et Na+ (ENa) restent donc constants. Le potentiel de membrane (Vm), qui va s'établir, est donc intermédiaire entre les potentiels d'équilibre des deux ions, soit entre EK (-87 mV) et ENa (+ 60 mV).
Le potentiel de membrane de la cellule (Vm) atteindra un état stable quand le flux net des charges (K+ & Na+) passant à travers la membrane sera nul, soit, en termes de courants ioniques, quand INa + IK = 0.
Or nous savons que :
IK = gK (Vm - EK)
INa = gNa (Vm - ENa)
Quand :
gK (Vm - EK) + gNa (Vm - ENa) = 0
Vm = (gK . EK + gNa . ENa) / (gK + gNa)
La valeur du potentiel de membrane dépend de la conductance relative des deux ions, leurs potentiels d'équilibre restant constants, et donc du rapport gNa / gK
Si a = gNa/gK :
Vm = (EK + a. ENa) / 1 + a
|
|
Dans notre exemple, où Vm = -60 mV, EK = -87 mV et ENa = + 60 mV, a = 0.2, ce qui signifie que la conductance des ions K+ est 5 fois plus grande que celle des ions Na+ soit : gK = 5. gNa.
Dans la majorité des cellules au repos, il y a beaucoup plus de canaux K+ que de canaux Na+ ouverts. Mais, le courant sortant potassique n'est cependant pas 5 fois plus important que le courant entrant sodique car le gradient électrochimique potassique (Vm - EK = + 27 mV) est beaucoup moins important que le gradient électrochimique sodique (Vm - ENa = - 120 mV). En fait, 2 ions K+ sortent de la cellule quand 3 ions Na+ y entrent. La cellule nerveuse aurait donc tendance à se vider de son K+ et à se remplir de Na+ si un système de transport actif, et donc consommateur d'énergie, ne venait rétablir l'équilibre en expulsant 3 ions Na+ contre l'entrée de 2 ions K+.
|
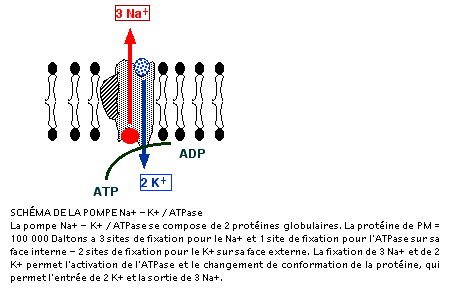
5. LA POMPE Na / K / ATPase MAINTIENT LES CONCENTRATIONS IONIQUES EN K+ ET Na+ INTRA- ET EXTRACELLULAIRE CONSTANTES
|
|
Une expérience, aujourd'hui classique, utilisant du Na+ radioactif, montre que du Na+ est perpétuellement rejeté de la cellule contre son gradient électrochimique. Un axone géant de calmar est incubé quelques minutes dans du liquide de Ringer contenant du Na+ radioactif : le Na+ radioactif pénètre par diffusion passive dans l'axone, en fonction du gradient électrochimique du Na+.
- L'axone est ensuite placé dans un milieu normal : le milieu s'enrichit progressivement en Na+ radioactif, qui ne peut provenir que de l'axone (sortie de Na+), et ce par un mécanisme de transport actif qui s'oppose au gradient électrochimique du Na+.
- Si l'axone empli de Na+ radioactif est plongé dans un milieu contenant du dinitrophénol (DNP), soit un inhibiteur du métabolisme cellulaire, le flux sortant de Na+ s'arrête, et ce de façon réversible : la sortie de Na+ est donc bien un phénomène actif lié à des processus métaboliques. L'ATP étant la plaque tournante du métabolisme énergétique dans la cellule, l'adjonction d'ATP au milieu contenant du DNP provoque bien une reprise de la sortie du Na+, dont l'importance est proportionnelle à la quantité d'ATP ajoutée.
- Si l'axone empli de Na+ radioactif est plongé dans un milieu dépourvu d'ions K+, le flux sortant de Na+ s'arrête également : la sortie de Na+ dépend de la présence d'ions K+ dans le milieu ([K+]e).
- En modifiant les concentrations de Na+ intracellulaire, on peut également montrer que la sortie de Na+ de l'axone est fonction de la concentration intracellulaire en Na+ ([Na+]i).
Le modèle, encore hypothétique, de la pompe Na+/K+/ATPase postule l'existence d'une protéine transmembranaire dont la partie externe aurait 3 sites de liaison : 2 sites pour les ions K+ et un site pour l'ouabaïne (bloquant de la pompe). - la partie interne de la protéine, située vers le cytoplasme de la cellule, porterait le site de liaison de l'ATP et 3 sites de liaison pour les ions Na+. Chaque fois que 3 ions Na+ sont expulsés de la cellule, 2 ions K+ entrent dans la cellule.
|
Iconographie personnelle - Dr. D. Rose
|
|
